
トピック・ニュース
東京大学大学院の渡邉俊樹教授を中心とする研究グループは、HTLV-1感染者コホート共同研究班JSPFADの全面的協力を得て、世界で初めてATL患者細胞のDNA, mRNA, microRNA(miRNA)の大規模な統合解析を完了した。その結果、ATL細胞の悪性化を引き起こす原因として、miRNA-31(miR-31)がすべてのATL患者で著しく減少していることが明らかになった。このmiR-31の発現欠損が、NF-κB経路の活性化を介してATL細胞の生存と増殖を支配していることが示された。miR-31はATLの革新的な治療法の新たな分子標的となる可能性がある。 (Yamagishi et al., Cancer Cell, 21, 2012)
Polycomb-Mediated Loss of miR-31 Activates NIK-dependent NF-κB Pathway in Adult T-cell Leukemia and Other Cancers
Makoto Yamagishi, Kazumi Nakano, Ariko Miyake, Tadanori Yamochi, Yayoi Kagami, Akihisa Tsutsumi, Yuka Matsuda, Aiko Sato-Otsubo, Satsuki Muto, Atae Utsunomiya, Kazunari Yamaguchi, Kaoru Uchimaru, Seishi Ogawa, Toshiki Watanabe.
Cancer Cell, 21, 121–135 (2012).
成人T細胞白血病から明らかになった新たなクロストーク:Polycomb−miR-31−NF-κB経路の異常とがん
| 〈著者〉 | 山岸誠1、中野和民1、三宅在子1、矢持忠徳1、加賀美弥生1、包明久1、松田有加1、佐藤(大坪)亜以子2、武藤早紀1,2、宇都宮與3、山口一成4、内丸薫5、小川誠司2、渡邉俊樹1 〈著者所属〉 1東京大学大学院新領域創成科学研究科 2東京大学医学部 3今村病院分院、血液内科 4国立感染症研究所、血液安全性研究部 5東大医科学研究所付属病院、血液内科 |
|---|---|
| 〈著者email〉 | myamagishi@mgs.k.u-tokyo.ac.jp ; tnabe@ims.u-tokyo.ac.jp |
〈要旨〉
ATLは日本人に100万人以上、世界では2000万人の感染者がいるHTLV-1によって引き起こされる重篤な白血病で、有効な治療法は確立していない。筆者らはHTLV-1感染者コホート共同研究班JSPFADの全面的協力を得て、世界で初めてATL患者細胞のDNA, mRNA, microRNA(miRNA)の大規模な統合解析を完了した。その結果、ATL細胞の悪性化を引き起こす原因として、miRNA-31(miR-31)がすべてのATL患者で著しく減少していることを明らかにした。miR-31の減少は標的遺伝子であるNIKの過剰発現とそれに伴うNF-κBシグナルの恒常的活性化を誘発すること、miR-31を再導入すると細胞死が誘導される事が示された。ゲノムの欠損及びPolycombファミリー依存的なエピジェネティックな異常がmiR-31の発現欠失の原因であり、またATLだけでなく乳がん細胞やB細胞における免疫応答反応でも同機構が保存されていることがわかった。従ってPolycombファミリー、miR-31、NIKのバランスが細胞の運命に重要であることが示された。Polycombファミリーは細胞の恒常性や分化などの多彩な機能に必須であると同時に、その異常は多くのがん細胞で重要な分子標的となる。miRNAを介したPolycombとNF-κBのクロストークは新たな概念であり、本研究の成果によりエピジェネティックな異常がNF-κBの恒常的活性化を介してアポトーシス抵抗性の獲得に寄与することが明らかとなった (図1)。
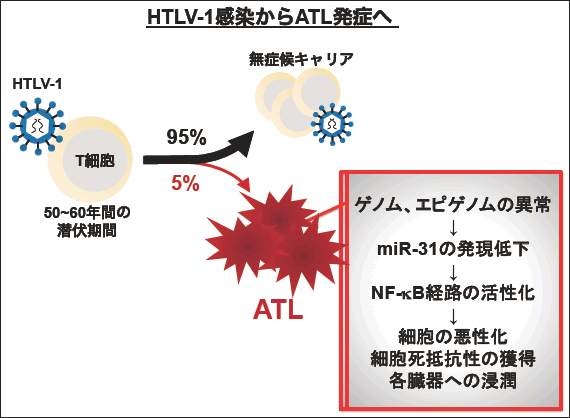
図1. HTLV-1感染とATLのモデル
ATLはHTLV-1感染者(キャリア)の約5%で発症する。白血病細胞はウイルス遺伝子の発現が低く、様々な遺伝子異常の蓄積によってシグナル伝達系の撹乱が起こっている。miR-31はATL全例で低下しており、腫瘍細胞の悪性化に寄与する。
[イントロダクション]
成人T細胞白血病(Adult T cell leukemia/lymphoma, ATL)はヒトT細胞白血病ウイルスⅠ型(Human T cell leukemia virus type 1, HTLV-1)の感染によって引き起こされる重篤なT細胞性白血病/リンパ腫である。50~60年という長い潜伏期間にHTLV-1感染末梢血T細胞に複数の遺伝子異常が蓄積しがん化が引き起こされる。現在世界には2000万人以上の感染者がいるとされるが、日本は特に多く、約120万人の感染者が存在し毎年約1000人を超える感染者が極めて予後が不良なATLを発症する。白血病やウイルスの発見当時から、この分野における日本人研究者の貢献度は多大であるが、ウイルスによる細胞の不死化や腫瘍化、治療抵抗性などの分子メカニズムは未だに不明な点が多く残されており、有効な治療法は未だに存在しない。ウイルスの根絶と白血病の予防、新規治療法開発を目指した分子レベルの病態解明が必須である(文献1)。
ATL細胞及びHTLV-1感染細胞の生物学的な特徴として、恒常的なNF-κBシグナル経路の活性化があり、これによって細胞の異常な増殖及び生存が確保されている(文献2)。HTLV-1感染細胞ではウイルス遺伝子であるTaxがNF-κBの定型的(canonical)及び非定型的(noncanonical)経路を劇的に活性化するが、通常Taxの発現が認められないATL腫瘍細胞におけるNF-κBの活性化メカニズムは不明な点が多かった。その後、遺伝子発現解析によってNF-κB inducing kinase (NIK)のmRNAの過剰発現が恒常的なNF-κBの活性化に寄与していることが明らかになっているが(文献3)、NIKの異常発現機構は明らかになっていなかった。NF-κBシグナルの異常な活性化とそれに伴う腫瘍細胞の生存能の獲得と悪性化は、ATLだけでなく多くの固形癌や悪性リンパ腫、白血病で共通して見られるがん細胞の特徴の1つである。その中でもNIKの高発現による異常活性化は重要な位置を占めているが、正常を逸脱するその機構は不明であり、がん研究全体の課題であった。
筆者らは本研究において、ATLのmiRNA、mRNA発現解析及びゲノム異常の解析を統合してATLの分子病態の全貌にアプローチした。その結果明らかとなったATLの分子異常は臨床的特徴をよく反映しており、分子マーカーや治療標的として様々な情報を提示した。さらに、明らかとなった新たな分子メカニズムはがん研究全体に新たな概念を提唱した。
[研究成果]
1. ATL臨床検体を用いた大規模統合解析からみるATLの分子病態
これまでのATL研究の多くは細胞株か、少数の患者由来細胞から得られた情報を基盤としたものが主であり、実際のATL細胞を分子レベルで正確に理解することがATL/HTLV研究において重要な課題であった。未だに有効な治療法が無いATLに対して根本的な情報を得るために筆者らはまず、全国的なHTLV-1疫学調査および検体バンク組織JSPFAD(http://htlv1.org/)の全面的な協力を得て、ATLの臨床検体を用いたmiRNAおよびmRNAの大規模解析に着手した。Agilent Technologies社のmiRNAマイクロアレイを用いてATL40例、正常CD4+T細胞22例について解析を行った結果、非常に厳しい検定をクリアした61個のmiRNAの発現異常を同定した。他のがん細胞の報告と同様に、ATL細胞では正常T細胞に比べて異常を示すmiRNAのほとんどが発現の低下であった。ATLのmiRNA発現パターンはユニークであり、miRNAの発現をもって正常T細胞と区別ができることもわかった。この61個のmiRNAのなかで一番差が大きかったmiR-31は、正常T細胞では比較的発現量が高く、一方でATL細胞は非常に発現が低い、もしくは検出限界以下にまで低下していた。miR-31は乳がん細胞の転移能を始めとする様々な細胞機能に関わる重要なmiRNAで(文献4)、発現の欠損が細胞の運命に重要な意味を包含すると考えられた。
2. miR-31の発現減少とその生物学的意義
miRNAの主な生物学的機能は、標的遺伝子の3’UTRに結合することによって遺伝子発現を負に制御することである。外来の合成siRNAと異なり、miRNAの配列認識は揺らぎが特徴的であり、1つのmiRNAが複数個の遺伝子を制御することができる(Pleiotropic function)。細胞の運命に重大な影響を与える標的の遺伝子の探索には、物理的な抑制効果と同時に標的側の機能や挙動も重要な指標となり、従って多角的な実験的検証が必須になる。筆者らは、ATL全例で発現が欠損していたmiR-31のT細胞における生物学的意義を明らかにする為に、以下の検討を行った。①miR-31の標的遺伝子の予測を4つのアルゴリズムによって予測、②ATL細胞のmRNA大規模解析データとの擦り合わせによる検証、③変異を導入したレポーターアッセイ、④miR-31の増減に対する標的候補遺伝子の定量、⑤miR-31と標的遺伝子の関係の保存性。以上より、NF-κB inducing kinase (NIK)がmiR-31の新規標的遺伝子であることを明らかにした。NIKはNF-κBの非定型的経路の活性化に必須のリン酸化酵素であり、NIKの発現レベルがNF-κBシグナルの恒常的活性化に直接的に寄与することが複数のがんで報告されている。ATLではNIKのmRNA量が増加していることがわかっていたが(文献3)、過剰発現の原因は明らかにされていなかった。ATL患者から樹立された細胞株にmiR-31を過剰発現させると、NIK mRNA及びタンパク質レベルが低下し、NF-κBの活性レベルが低下することがわかった。これらの細胞では細胞増殖レベルの低下、抗アポトーシス遺伝子の発現低下、アポトーシス感受性の向上、が見られた。さらにmiR-31を発現誘導するレンチウイルスベクターは、ATL患者から直接取り出した腫瘍細胞をアポトーシスに誘導することがわかった(後述)。以上より、miR-31の発現低下はATL細胞の生存にとって重要であり、その分子メカニズムはNIKの過剰発現の誘導であることが示された。NF-κBシグナルは非常に複雑な制御機構を備えているが、本研究によりmiR-31が新たなNF-κB抑制因子として同定された。
3. ゲノム及びエピゲノムの異常とmiR-31の発現制御
細胞内の成熟miRNAのダイナミズムは、転写制御と、転写後の成熟過程の制御によって規定される。ATL全例で発現欠損があるmiR-31は、転移性乳がんや前立腺がんなどでも発現が減少しており、がん細胞における一般性と重要性が示唆されたが、細胞内のmiR-31レベルがどのように制御されるかについては不明であった。hsa-miR-31は、多くのがん細胞でゲノムの欠失が頻発する9p21.3のCDKN2A/B領域に隣接しており、ATLにおいてもゲノムの不安定性が予測された。筆者らのATL168症例の大規模なDNAコピーナンバー解析の結果、12.5%の症例でmiR-31ゲノムのホモもしくはヘテロの欠損があることがわかった。一方で、同時に行ったmiRNA発現解析では、ゲノムの欠損が無い症例でも正常T細胞に比べてmiR-31レベルが大きく減少していることがわかった。そこで発現解析データとアルゴリズムからmiR-31の転写構造を予測すると、miR-31はLOC554202遺伝子のイントロン領域にコードされ、独立した転写が起こっていることがわかった。また興味深い事に、YY1という転写因子の認識配列がmiR-31の転写開始点上流に蓄積していることに気がついた。このYY1は、Polycombファミリーに属するDNA結合タンパク質で、ヒストンH3K27のメチル化酵素であるEZH2を始めとするPolycomb repressive complex 2 (PRC2)のリクルーターとしての機能が注目されている (文献5)。そこでYY1のノックダウン実験を行ったところ、miR-31領域へのYY1の蓄積が低下し、それに付随してEZH2のリクルートが減少することがわかった。
ではATL細胞を始めとする高悪性度の腫瘍においてなぜmiR-31の発現が激減するのか?ATLのmRNA発現解析の結果、PolycombファミリーのヒストンH3K27のトリメチル化を誘導するEZH2及びSUZ12遺伝子の発現が正常T細胞に比べて高発現していることがわかった。ATL細胞株においてこれらのPolycombファミリー遺伝子をノックダウンすると、miR-31ゲノム領域へのPRC2のリクルートレベルが低下し、その結果H3K27及びH3K9のメチル化のレベルが低下した。さらに、ヒストンの脱アセチル化を介して転写抑制に働くHDAC1の結合レベルも低下し、その結果miR-31の発現が回復することがわかった。以上の実験データからPolycombファミリーの発現異常がmiR-31の発現低下を誘導するという新たな分子メカニズムが明らかとなった。この事実は以下のデータからもサポートされる。①ATL患者由来腫瘍細胞をChIPアッセイによって直接調べた結果、hsa-miR-31領域に異常な抑制的メチル化ヒストンが検出され、またEZH2のノックダウンが直接細胞死を誘導した(後述)。②同様の分子メカニズムが好転移性乳がん細胞やB細胞株においても保存されていた。
以上より、細胞内における成熟miR-31の発現レベルはゲノムの安定性と、YY1-PRC2 によるエピジェネティックな制御の両側面により規定されることが示された。
4. PolycombファミリーによるmiR-31制御を介したNF-κB経路への影響
miR-31はNIKの他にRhoA、Radixin、Integrin α5、FoxP3、FIH、E2F2など様々な遺伝子を負に制御し、細胞の運命に強く影響する。一方でmiR-31を制御するPolycombファミリーは多くの悪性リンパ腫、白血病、固形癌の増殖、生存、転移能に重要な因子であるが、どの標的遺伝子が細胞の表現型に直接影響するかは不明な点が多かった。筆者らは、本研究で明らかとなった、①miR-31によるNIKを介したNF-κB経路の制御と、②PolycombファミリーによるmiR-31の発現制御を合わせ、Polycombによるエピジェネティックな制御がNIK依存的なNF-κB経路の制御に関わる、という仮説を立てた。これまでPolycombファミリーとNF-κB経路の関係は不明であった。
ATL細胞株においてEZH2もしくはSUZ12をノックダウンすると、上記のようにmiR-31の発現が誘導され、このときNIKのレベルが低下することによって下流のシグナルが停止し、NF-κB活性レベルが低下した。さらにこれらの細胞では細胞増殖及び細胞死抵抗性が低下した。
Polycomb、miR-31、NIKは各経路の上流に位置する因子で、細胞に対するアウトプットは様々に拡散すると考えられるが、以下の実験事実により、上記の分子機構は非常に重要であると考えられる。①Polycombファミリーのノックダウンによって低下したNF-κB活性レベルは、miR-31の阻害剤を共存させることによって回復することから、PolycombによるNF-κBの制御はmiR-31の仲介が重要である。②Polycombのノックダウンによって誘導されるATL細胞の強制的なApoptosisは3’UTRを持たないNIKによってレスキューされる。つまりPolycombファミリーによって獲得する異常な生存能の一部はNIKによって具現化される③miR-31の過剰発現やPolycombのノックダウンは、B細胞におけるBAFFやCD40Lからの非定型的NF-κB経路の活性化を阻害することから、がん細胞シグナルだけでなく、正常細胞のシグナルの調整にも重要である。④miR-31の発現及びPolycombのノックダウンによりATL細胞のMDC(CCR4リガンド)に対する走化性が低下した。NIK以外のmiR-31の標的遺伝子群による表現型はPolycombファミリーによっても影響を受ける。
5. 新規治療法の開発へ
Polycombの過剰発現、miR-31の発現欠損、NIKの上昇とNF-κBの恒常的活性化は、いずれもATLの臨床検体から明らかになった。筆者らは本研究の総括として、上記の腫瘍細胞の分子レベルの特徴が細胞の生存にどのように影響するかを検討した。miR-31の強制発現、EZH2もしくはNIKのノックダウンを行うレンチウイルスベクターを作製し、患者由来腫瘍細胞に直接導入することによってex vivoの評価を行った。その結果、ある程度の個人差をもって、いずれのレンチウイルスも複数のATL症例で強烈なアポトーシスを誘導することがわかった。同様の処理は正常の末梢血単核球もしくはT細胞に対しては効果が微弱であり、異常な分子レベルのバランスがATL腫瘍細胞の生存に重要であることが示された。これらの結果は、miR-31がATL細胞特異的な細胞障害性を持つことを示しており、ATL細胞特異的な導入法を開発することにより、ATLの新規治療法につながる可能性を持つと考えられる。
[考察と今後の展望]
本研究は、ATLにおける新たな分子標的とNF-κBの活性化機序を明らかにしたとともに、Polycombによるエピジェネティックな制御、miRNAによる細胞運命の決定、NF-κBシグナル経路による免疫細胞及び腫瘍細胞の分子基盤、という3つのコンテクストに新たな生物学的リンクを見いだした(図2)。また、本研究で得られた知見は以下の点で重要である。
1つ目は、NIKの新たな制御機構を明らかにしたこと。NIKはATL以外に多発性骨髄腫、悪性リンパ腫、乳がんなどのNF-κB異常活性化の原因因子である。また免疫担当細胞を始めとする種々の細胞の正常機能にNIKは必須であり、NIKを巡る基礎研究は注目をあつめている。NF-κB経路の複雑な制御システムにmiR-31が組み込まれていること、さらにPolycomb依存的なエピジェネティックな制御がmiRNAを介してNF-κB制御に寄与するという発見は、今後のシグナル伝達研究に対して大きく貢献すると考えられる。
2つ目は、Polycombファミリーは、miRNAの発現を制御することによって、より多くの遺伝子発現を転写及び翻訳の段階で影響力を持つ可能性がある。またPolycombファミリー自身も複数のmiRNAによって制御されることが分かっている。現に、ATLにおいてはEZH2を抑制するmiRNA群が減少を示していた。
3つ目は、Polycombファミリーによる標的領域に認識機構の一端を明らかにしたこと。PRC2の標的配列の認識はYY1だけでは説明できないことは複数の研究によって示されているが、miR-31のようにYY1結合配列の蓄積という特殊なケースが細胞に対する影響力が大きい可能性がある。
4つ目は、シグナルのクロストークと細胞の正常機能について。本研究で得られた知見はそれぞれの鍵分子の異常な挙動を指標にして明らかとなったが、各分子は元来、細胞の恒常性や正常機能に重要であると考えられる。がん研究から得られた知見がより基礎及び臨床的な理解へと貢献することを期待する。
最後に、前項でも触れた様に、miR-31のATLに対する分子標的薬としての応用可能性が示されたと言える。今後の研究により実用化が可能になれば、ATLのみならず同様の病態を示すがんの新たな治療法開発の先例となる可能性がある。
本研究はCancer Cell誌、同刊のプレビューにて本研究解説が掲載されている (文献6)。
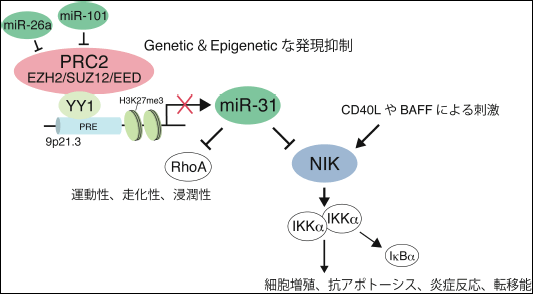
図2. Polycomb依存的なmiR-31の発現低下はNIKなどの標的遺伝子を介して細胞の表現型に影響する。この分子間の関係は様々な細胞で保存されており、各因子の存在量のバランスによって均衡が保たれている。バランスを崩した細胞は悪性化をたどると考えられる。
〈文献〉
- Iwanaga, M., Watanabe, T., Utsunomiya, A. et al.: Human T-cell leukemia virus type I (HTLV-1) proviral load and disease progression in asymptomatic HTLV-1 carriers: a nationwide prospective study in Japan. Blood, 116, 1211–1219 (2010).
- Watanabe, M., Ohsugi, T., Shoda, M. et al.: Dual targeting of transformed and untransformed HTLV-1-infected T cells by DHMEQ, a potent and selective inhibitor of NF-kappaB, as a strategy for chemoprevention and therapy of adult T-cell leukemia. Blood, 106, 2462–2471 (2005).
- Saitoh, Y., Yamamoto, N., Dewan, M.Z. et al.: Overexpressed NF-kappaB-inducing kinase contributes to the tumorigenesis of adult T-cell leukemia and Hodgkin Reed-Sternberg cells. Blood, 111, 5118–5129 (2008).
- Valastyan, S., Reinhardt, F., Benaich, N. et al.: A pleiotropically acting microRNA, miR-31, inhibits breast cancer metastasis. Cell, 137, 1032-1046 (2009).
- Simon, J.A. and Kingston, R.E.: Mechanisms of polycomb gene silencing: knowns and unknowns. Nat. Rev. Mol. Cell. Biol., 10, 697-708 (2009).
- Uribesalgo I., Ballare C., and Croce LD.: Polycomb Regulates NF-κB Signaling in Cancer through miRNA. Cancer Cell, 21, 5-7 (2012).
